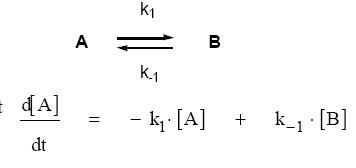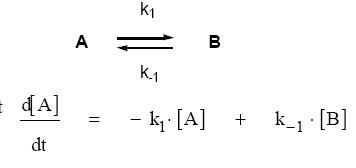Message
par Calamity » 02 juin 2006 17:54
La première ligne t'indique qu'il existe un équilibre entre deux espèces A et B, la double flèche signifiant que la réaction peut se produire dans les deux sens.
La réaction A -> B (sens direct) a pour constante de vitesse k1 donc sa vitesse est v1 = k1[A], la réaction B -> A (sens indirect) a pour constante k-1 donc sa vitesse est v-1 = k-1.
La vitesse de formation de A est vA = d[A]/dt.
A est consommé dans le sens direct, formé dans le sens indirect donc on a vA= d[A]/dt = -v1 + v-1 = -k1[A] + k-1